Nature系列综述:21世纪以来FDA批准癌症疗法的趋势
- 民间偏方
- 2023-11-13
- 153
原创 生物世界 生物世界
编译丨王聪
编辑丨王多鱼
排版丨水成文
自上个世界末以来,癌症治疗领域发生了巨大变化,使癌症患者的治疗效果得到了实质性改善。近日,美国FDA药物评价与研究中心肿瘤疾病办公室的研究人员在 旗下综述期刊 Drug 上发表了题为: in the of by the FDA in the -first 的综述论文。
该综述总结了2000年1月至2022年10月美国FDA批准的癌症治疗产品的趋势,并根据这些产品的作用机制和主要靶点进行了分类。
21世纪以来,由于靶向治疗的出现,肿瘤适应症的批准率在这段时间内有所增加,新治疗方法的引入率也有所增加。激酶抑制剂是获批产品和适应症数量最多的产品类别,而免疫检查点抑制剂虽然直到2011年才首次获批,但获批数量仅次于激酶抑制剂。该综述还展望了未来癌症治疗产品开发趋势,以及新治疗方法和技术带来的影响。

对癌症治疗产品的研究可以追溯到20世纪初(1900年代),当时“化疗”一词被创造出来,一些最初的实验显示出了治疗希望。但直到1949年,FDA批准了第一个化疗药物氮芥(),用于治疗非霍奇金淋巴瘤,而它的发现则是基于第二次世界大战期间盟军对化学武器的研究。
此后几十年里,癌症治疗产品仅限于影响快速分裂细胞的全身细胞毒性药物,而除了癌细胞外,有些健康细胞也在快速分裂,因此,这些化疗药物通常具有很大的毒性。
直到20世纪90年代末和21世纪初,随着靶向疗法的出现,癌症治疗前景发生了巨大变化,靶向治疗旨在利用癌细胞的遗传易感性,选择性杀死这些癌细胞。1998年,曲妥珠单抗(Her2单克隆抗体)被批准用于治疗乳腺癌;2001年,伊马替尼(BCR-ABL的小分子抑制剂)被批准用于治疗慢性髓系白血病。它们的获批上市被认为开启了精准肿瘤学时代。
21世纪一来,对癌症患者的治疗效果有了进一步改善。以美国为例,从1995-1999年,美国所有癌症的年龄调整死亡率为206人/10万人,而在2014-2018年,这一比例下降到了155.5人/10万人。从2016-2017年,癌症总死亡率实现了2.2%的最大单年下降幅度,这是由于肺癌死亡率的快速下降,其部分原因是免疫检查点抑制剂(ICI)和其他新的靶向疗法的获批。
肿瘤学批准的总体趋势
2000年1月1日至2022年10月31日期间,共有206种不同的肿瘤学产品获得了573项肿瘤适应症批准,其中50项为细胞毒性药物,277项为靶向药物,246项为靶向生物制剂。
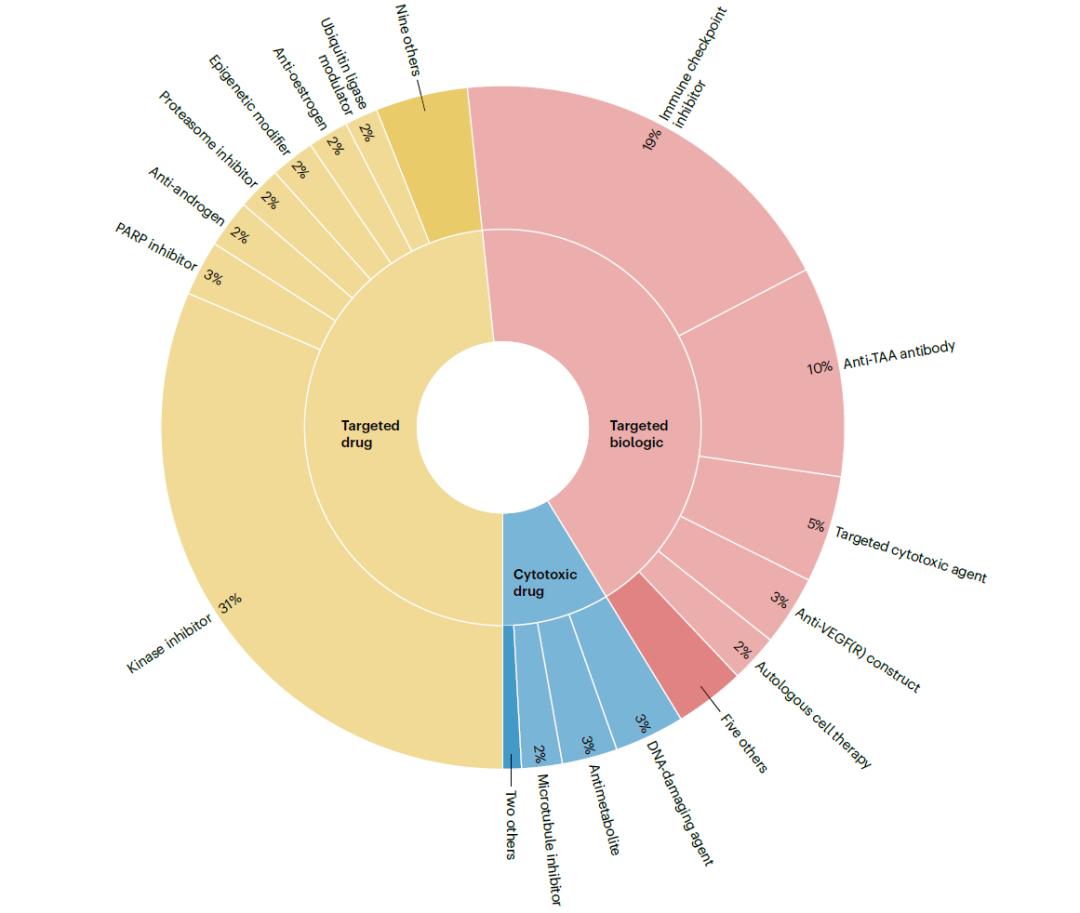
这些产品被分为99个亚类,这些亚类组成31个类,这些类组成3个组(细胞毒性药物、靶向药物、靶向生物制剂)。
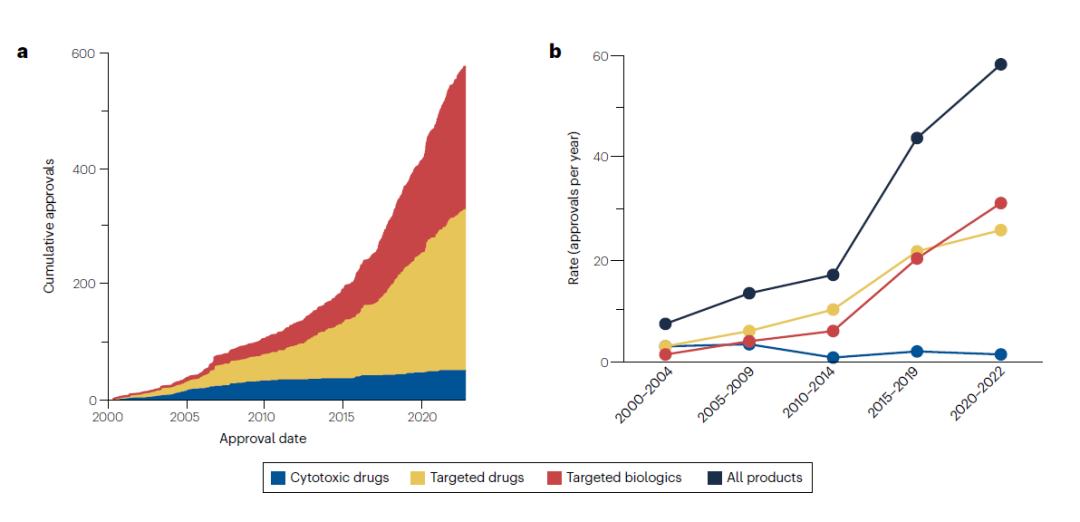
在整个分析期间期间,批准率急剧上升。每5年期平均年度批准数量从2000-2004年的7.4个/年,增加到了2017年11月-2022年10月的56个/年,增长率达757%。自2009年以来,这一增长趋势完全是由靶向药物和靶向生物制剂的批准率增加所驱动的,而细胞毒性药物的批准率则相当低,并且在分析期间略有下降。
2000-2019年,靶向药物的审批率略高于靶向生物制剂,但2020-2022年,靶向生物制剂的审批率超过靶向药物。
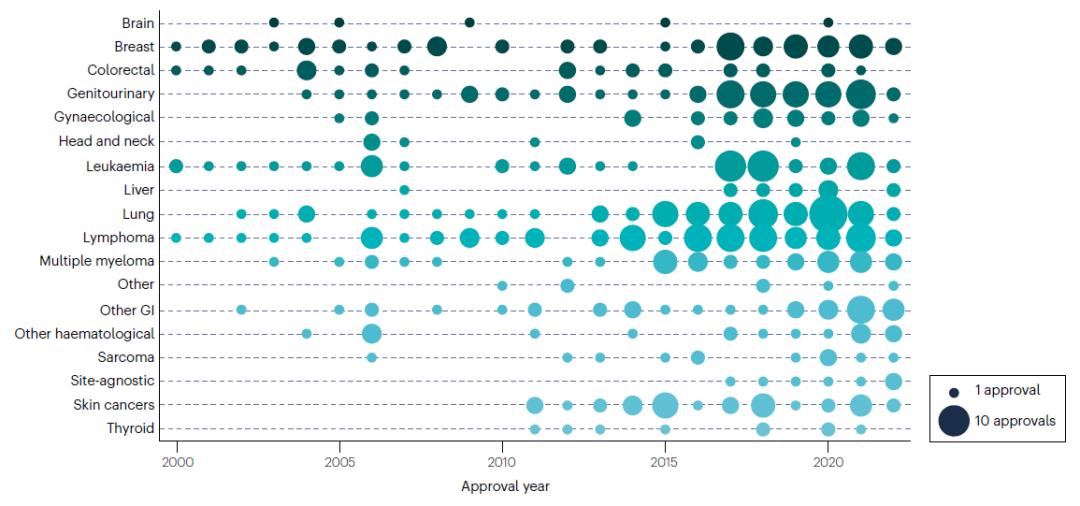
在整个分析期间,治疗产品批准的数量和时间点因疾病部位而异。在整个分析期间,乳腺癌、白血病和淋巴瘤都获得了新批准,自2014年以来这几种癌症的批准率普遍上升。在整个分析期间,对于脑癌和头颈癌的批准数量很少,而对于皮肤癌和甲状腺癌,在2000-2010年没有新产品批准后,但近年来每年的批准数量显著增加。自2015年以来,获批最多的是肺癌、淋巴瘤、泌尿生殖系统癌症、乳腺癌和白血病,在过去8年中,这几种癌症的每一种获批量均≥35个。
治疗产品类别的批准趋势
所有获批的产品可分为三组(细胞毒性药物、靶向药物、靶向生物制剂),根据作用机制进一步分为31类。
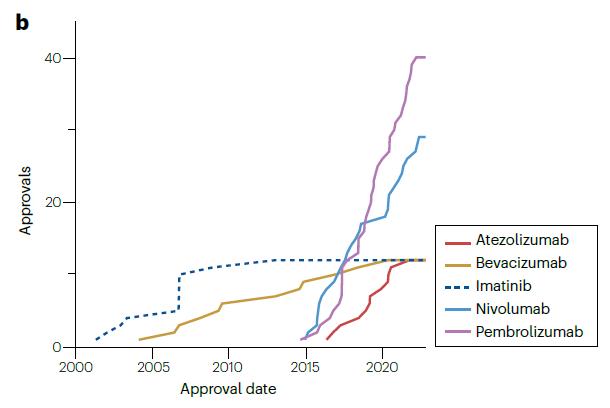
从下图可以看出,激酶抑制剂(属于靶向药物)是获批数量最多的,而且在整个分析期间都有新批准,此类药物中最早获批的是于2001年的伊马替尼。获批数量第二高的类别是免疫检查点抑制剂(属于靶向生物制剂),此类药物最早或批的是2011年的伊匹单抗。激酶抑制剂和免疫检查点抑制剂在2022年的批准数量相同,都是9个,在此之前的5年获批数量分别为91个和82个。
综上所述,这些结果表明了免疫检查点抑制剂自2011年首次获批以来所产生的巨大影响,同时也显示了激酶抑制剂在整个肿瘤治疗产品领域的持续重要性。
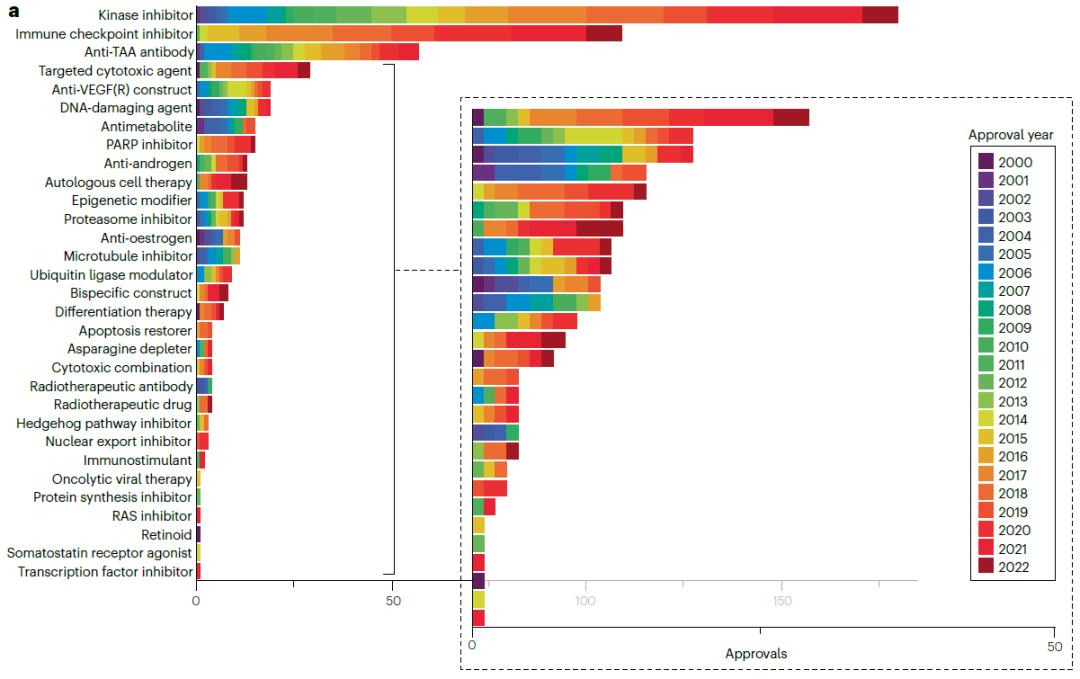
自2000年以来,有5种不同的产品分别获得了12个或更多的批准,其中3种是免疫检查点抑制(派姆单抗、纳武单抗和阿替利珠单抗),1种是血管内皮生长因子抑制剂(贝伐珠单抗),以及1种激酶抑制剂(伊马替尼)。
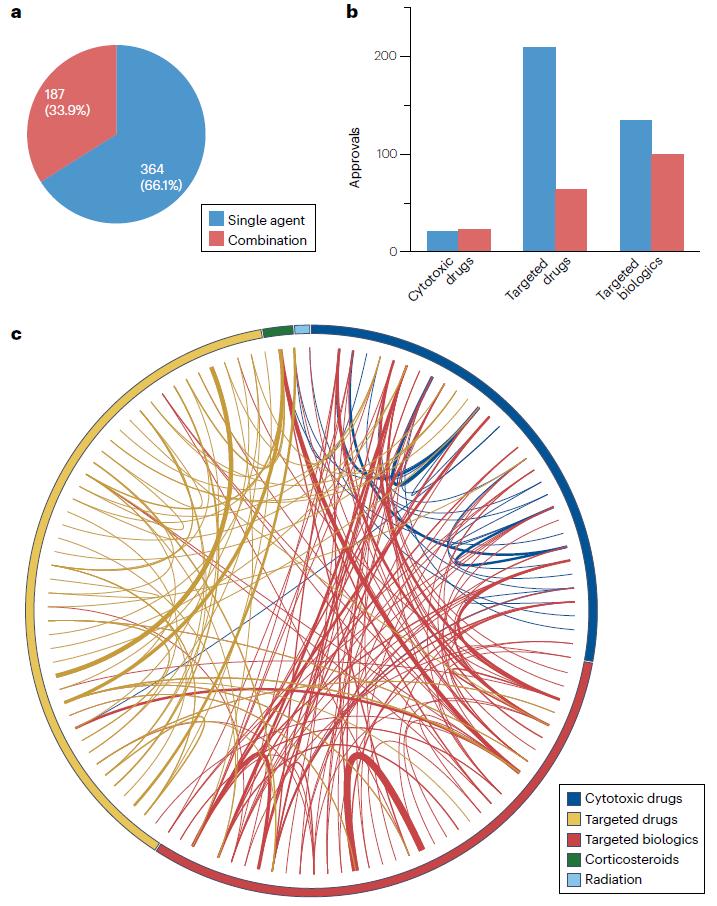
单药和联合用药审批的趋势
自2000年以来,单药适应症占肿瘤产品批准的约三分之二(364/551),其余约三分之一(187/551)是联合用药。细胞毒性药物获批中联合用药占比最高(52%),其次是靶向生物制剂(43%),最后是靶向药物,联合用药获批适应症仅占该组获批的23%。
某些产品类别中,作为联合用药获批的比例高于作为单药获批的比例,例如天冬酰胺消耗剂,100%作为联合用药获批、微管抑制剂(80%)、抗VEGF(76%)、抗肿瘤相关抗原抗体(75%)、核输出抑制剂(67%)。在某些疾病中,联合用药获批也比单药获批比例更高,例如,发性骨髓瘤,66%的获批是联合用药、结直肠癌(65%)、乳腺癌(63%)、脑癌(60%)和头颈癌(57%)。
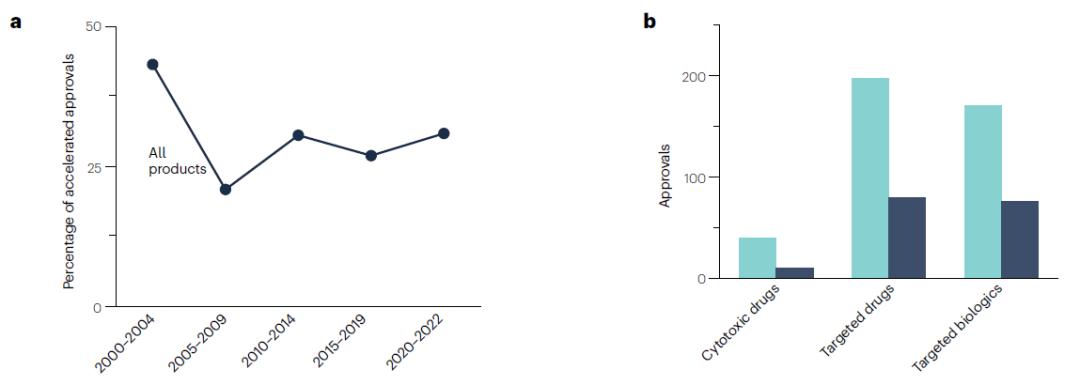
审批途径的趋势
加速审批( ,AA)途径是1992年引入的一种替代传统审批的产品审批途径,最初专注于在艾滋病危机期间加快产品开发。如今,这一途径成为针对治疗严重或危及生命的疾病(包括癌症)的产品的加速方案,这允许变革性产品提前几年获得批准。但如果其临床益处没有在后续得到证实,获批的产品或适应症可能会被撤回。截至2022年10月31日,共有18个加速审批产品被撤回,所有这些产品都是靶向药物或靶向生物制剂,其中免疫检查点产品有7个、激酶抑制剂有5个,表观遗传修饰剂为2个。
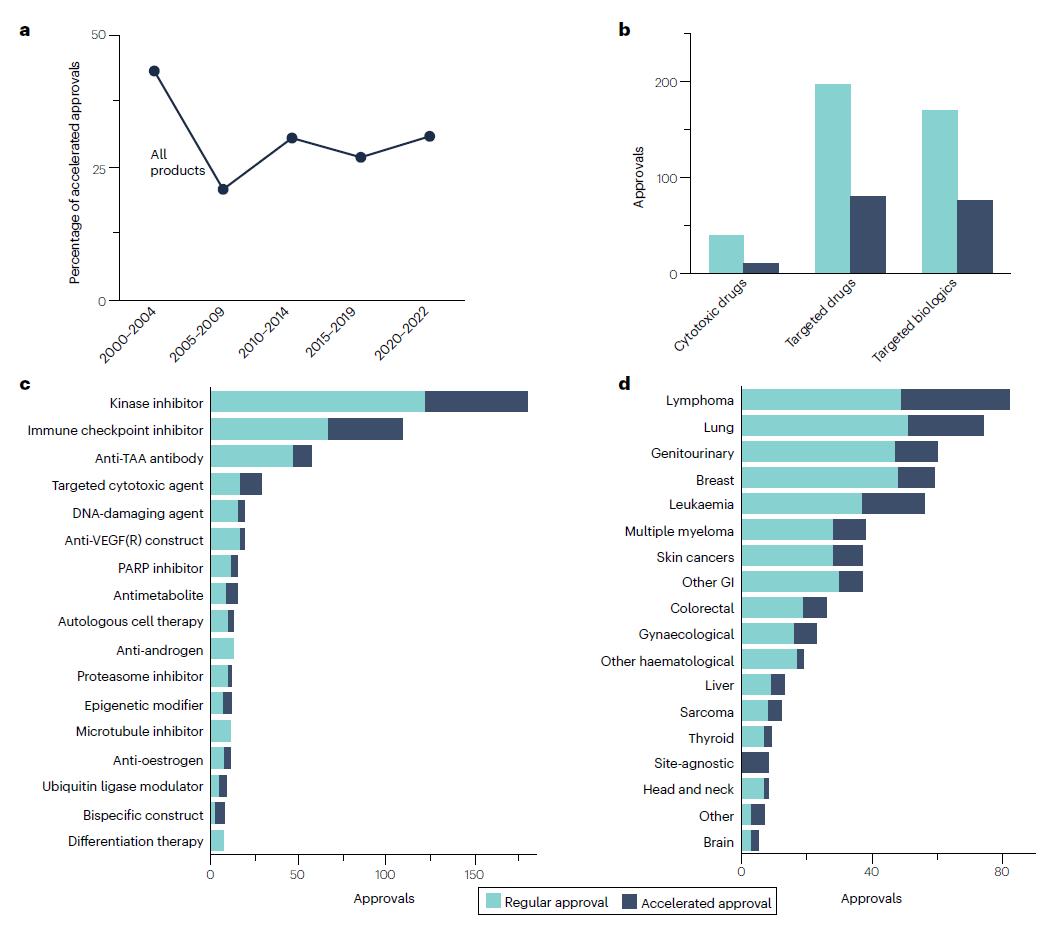
在整个分析期间,71%的批准(407/573)使用常规批准途径,29%(166/573)使用加速审批途径。近年来加速审批总数有所增加,但这反映了整个分析期间治疗产品批准率的总体增加,而不是加速审批在肿瘤学中使用的比例增加。在加速审批中,靶向生物制剂使用加速审批的比例最高(31%),靶向药物的试用比例略低(29%),细胞毒性药物的使用比例最低(20%)。
在不同的产品类别中,加速审批和常规审批的使用比例差别很大。有12类产品没有任何加速审批,还有2类产品全都是加速审批,分别是蛋白质合成抑制剂和RAS抑制剂。在至少有10个获批的类别中,加速审批使用率最高的是表观遗传修饰剂(42%)、靶向细胞毒性药物(41%)、抗代谢药物(40%)和免疫检查点抑制剂(39%)。激酶抑制剂的加速审批数量最多(58个),但加速审批进展激酶抑制剂类别获批的32%。
在不同癌症类型中,获批的药物所使用的审批途径也有所不同,在18种癌症分类中,有16种以常规审批为主。最常用加速审批的癌症类型是淋巴瘤(40%)、脑癌(40%)和白血病(34%),而最低的是血液肿瘤(11%)、头颈癌(13%)和乳腺癌(19%)。
总结
自2000年以来,肿瘤学治疗产品的开发速度有所提高。靶向药物和靶向生物制剂的发展迅速,而细胞毒性药物的发展速度却放缓了。以新产品亚类的引入率来衡量,肿瘤治疗方法的创新有所增加。激酶抑制剂仍然是主要的产品类别,但自2011年首个免疫检查点抑制剂伊匹单抗获批以来,免疫检查点抑制剂已经产生了相当大的影响。与所有其他产品亚类相比,抗PD-1抗体获批适应症的数量尤其突出。
自2009年以来,生物标志物在肿瘤适应症中的应用稳步增长,但鉴于近年来精准医疗的扩张,这一速度可能比预期的要慢。单药获批是最常见的,但联合用药已占批准的34%。近年来加速审批途径越来越多,这反映了肿瘤产品的整体增长,在整个分析期间,加速审批的使用率保持相对稳定,平均为31%。
总的来说,21世纪迄今为止,肿瘤治疗产品开发的步伐和创新都有所加快。随着许多有希望的方法和领域的进一步创新,这些趋势可能会继续下去,从而进一步改善肿瘤治疗和癌症患者的预后。
蛋白、抗体类生物大分子在生命体系中发挥着重要功能。在生物学基础研究领域,可用于探究蛋白质的结构、功能、相互作用等;在药物研发领域,靶点蛋白、抗体药物具有高效性和特异性,可用于多种疾病的治疗;在工业生产领域,可用于生产工业酶、饲料添加剂等,用于提高工业生产的效率和质量;在诊断领域,可作为原材料。总之,蛋白、抗体类生物大分子应用广泛,为生物学、医学和工业生产带来了许多创新和突破,因此,对它们的质量表征和分析显得尤为重要。
2023年7月6日(周四)19:00,义翘神州邀请王旭曼博士举办免费在线讲座“蛋白、抗体类生物大分子质量表征及分析技术”,本次讲座主要介绍蛋白、抗体类生物大分子的理化性质、生物活性及亲和力测定的表征分析方法,同时结合实际案例分享各类分析方法的实际应用。
讲座内容概述
1)生物大分子质量表征概述
2)质量表征之理化分析
3)质量表征之生物活性及亲和力测定
4)生物大分子试剂开发中的质量表征及应用案例
主讲人介绍:
王旭曼,高级质控经理(北京义翘神州科技股份有限公司)。王旭曼毕业于暨南大学。在北京义翘神州科技股份有限公司主要负责理化检测及ELISA、 Blot、流式及免疫组化/免疫荧光、SPR/BLI分子相互作用分析等平台的建设工作,具有丰富的分析检测经验。
长按扫描上方二维码,免费预约直播
直播间入口:
论文链接:
下一篇:敛肠丸
发表评论