PDE4B选择性抑制剂Ⅲ期临床试验在中国获批,全球同步启动!
- 民间偏方
- 2022-11-01
- 285
近日,中国国家药品监督管理局(NMPA)药品审评中心(CDE)官网公示,勃林格殷格翰( )申报的磷酸二酯酶4B(PDE4B)选择性抑制剂BI 片获得批准开展两项Ⅲ期临床试验,拟开发适应症分别为特发性肺纤维化( ,IPF)以及进行性纤维化性间质性肺疾病(ases,PF-ILD)。BI 的Ⅲ期临床试验中国地区将与全球同步进行并由中国医学科学院北京协和医院牵头,目前中国已经有45家临床研究中心有望参与该研究。
图1 CDE官网截图

直面“无因杀手”治疗困境,创新疗法打开新局面
间质性肺疾病(ase, ILD) 是一类复杂的、较难明确病因的,主要累及肺间质、肺泡和(或)细支气管的弥漫性肺部疾病,IPF大约占ILD的20%。PF-ILD,也被描述为具有进行性表型的慢性纤维化间质性肺疾病,是一组以慢性进行性纤维化性表型,自我维持的纤维化和肺功能持续恶化,同时伴随临床症状恶化、对治疗的反应较差并且生存期较短为特征的疾病。在ILD患者中,PF-ILD患者估计约占20%–30%
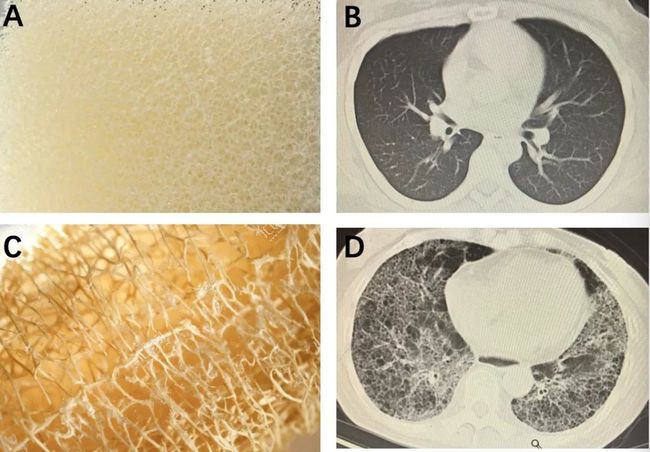
从目前这两种疾病的治疗手段上来看,尼达尼布或吡非尼酮的抗纤维化治疗可减缓肺功能下降,是IPF治疗的主要手段,且尼达尼布扩大了对PF-ILD治疗的适应症,成为第一个被批准用于治疗PF-ILD患者的药物,标志着PF-ILD治疗中的重大里程碑。虽然IPF直接的致病途径尚不明确,但肺纤维化的形成机理应该是肺泡上皮细胞损伤和修复的失调和重塑,许多促纤维化介质都有可能在IPF的发病机制中起重要作用,而PF-ILD也通过类似的机制发展——自我持续的细胞修复失调、成纤维细胞增殖机制和肺泡功能障碍。PDE4可通过特异性水解第二信使cAMP而调控促炎、抗炎细胞因子的产生,从而发挥一系列作用,因此PDE4也成为炎症性疾病的重要治疗靶点,PDE4抑制剂在抗纤维化方面的潜力亟待探索。
PDE4各种亚型(PDE4A~PDE4D)的活性位点具有高度相似性,而泛PDE4抑制剂无法区分不同亚型,对PDE4D的抑制可能与呕吐等胃肠道副作用相关,因此限制了其临床应用。通过设计有效的异构体提高PDE4抑制剂对某种亚型的高度选择性,有望减少不良反应。这也是新一代PDE4抑制剂的研发方向之一。勃林格殷格翰在研的PDE4B抑制剂()是一种对PDE4B酶具有选择特异性的下一代小分子抑制剂,对PDE4B亚型具有优先选择性,与其他上市的非选择性PDE4抑制剂相比耐受性有所改善,同时具有抗纤维化和抗炎作用,因此有潜力同时解决肺纤维化以及伴发的炎症。随着此次PDE4B选择性抑制剂Ⅲ期临床试验的获批,使得IPF与PF-ILD患者的希望之路再次被“点亮”。
PDE4B选择性抑制剂重燃肺纤维化治疗“新希望”
BI 在治疗IPF的Ⅱ期临床试验中取得积极结果,该试验结果已经发表于《新英格兰医学杂志》。2022年2月,BI 片获美国食品药品监督管理局(FDA)授予突破性疗法认定,用于治疗IPF。BI 针对IPF的Ⅱ期临床试验结果显示,服用BI 12周,患者的FVC中位值较基线水平竟显示出轻微改善,而在服用安慰剂的患者中,FVC则出现下降:

1)在未服用已批准抗纤维化药物治疗的患者中,服用BI 的患者FVC中位值增加了5.7mL,而服用安慰剂的患者FVC中位值下降了81.7mL。
2)在服用已批准抗纤维化药物治疗的患者中,服用BI 的患者FVC中位值增加了2.7mL,而服用安慰剂的患者FVC中位值下降了59.2mL。

3)在延缓IPF患者肺功能下降速度方面,BI 优于安慰剂的概率超过98%。
基于BI Ⅱ期研究展现出的令人鼓舞的临床数据,此次获批启动的Ⅲ期临床试验旨在IPF/PF-ILD患者中通过比较FVC较基线的变化来验证,相较于安慰剂,给予治疗可减缓肺功能的下降并降低试验期间具有临床意义的事件(如IPF/ILD急性加重、因呼吸系统原因住院或死亡)的发生率。主要研究终点是第52周FVC较基线的绝对值变化,关键次要终点:在试验期间至首次发生以下任一复合终点事件的时间:至首次IPF/ILD急性加重、首次因呼吸系统原因住院或死亡(以先发生者为准)。研究将会筛选IPF/PF-ILD患者,随机分配至 9mg bid, 18mg bid活性药物治疗组及安慰剂组。同时也将进一步评估患者耐受性与安全性,以期达到低毒高效的治疗效果,指导临床用药,重塑临床治疗格局。
PDE4B选择性抑制剂Ⅲ期全球多中心临床试验中国首家中心计划于2023年1月启动。针对IPF的试验计划在中国入组135名患者,针对PF-ILD的试验计划在中国入组149名患者,目前正在逐步推进中,属于中国IPF/PF-ILD患者的“中国治疗数据”指日可待。
勃林格殷格翰中国医学和研发负责人张维博士表示:“勃林格殷格翰始终致力于连接全球与中国,以同步研发的策略尽快将创新药物带入中国。得益于‘中国关键(China Key)’项目的优势,让中国的试验机构和IPF患者能够在BI II期临床试验阶段就参与其中,并于今年分别在美国胸科学会年会(ATS)以及《新英格兰医学杂志》公布了的II期临床试验结果。该研究数据振奋人心,也得到了中国监管机构的积极反馈。基于此,BI 的两项Ⅲ期临床试验在中国的获批时间仅45个工作日,基本与欧美保持同步,再次印证了勃林格殷格翰全球同步研发的信心和决心。我们将持续发挥勃林格殷格翰在肺纤维化治疗领域的全球市场领导者的作用,引领创新药物开发;也期待两项Ⅲ期临床试验取得预期的结果,与中国的监管机构和专家学者共同努力,不断优化肺纤维化诊疗规范,造福更多中国乃至全球患者。”
下一篇:足底按摩缓解颈椎问题
发表评论