曹雪涛研究团队揭示肿瘤外泌体促进肺促转移“龛”结构形成新机制
- 健康知识
- 2024-04-01
- 131
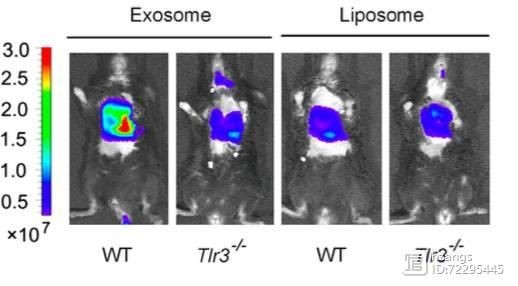
图:肿瘤外泌体通过TLR3促进小鼠转移性肺癌
肿瘤转移与癌症的死亡率密切相关,癌细胞传播到远处器官部位并适应新环境是转移的首要原因。这个过程是由肿瘤及其微环境之间的合作完成的。原发肿瘤可以促进新位置的肿瘤微环境的形成,目前被深入研究的有基质细胞组成特定结构通常被人们称为促转移“龛”结构 (pre- niche)。详细而言,骨髓来源的细胞(BMDC)会通过原发肿瘤产生各种因子被动员到不同的器官,形成促转移“龛”结构,这就类似与种子萌发生长所需要准备肥沃的土壤。这个过程涉及各种肿瘤分泌的因子和宿主基质微环境间的联系,并动员和招募BMDC至新的转移位点。原发肿瘤与远端器官间共同形成了良好的肿瘤转移前促转移“龛”结构,但是这个过程的重要机制并不完全清楚。
促转移“龛”结构(pre- niche)通过原发肿瘤产生的物质促进癌症转移。8月8日,来自第二军医大学曹雪涛研究团队在 Cell(IF=23.314)上发表了一篇题为“Tumor RNAs Lung Pre- Niche by TLR3 to ”的文章,他们发现,肺上皮细胞是中性粒细胞募集和肺转移利基形成的关键位置,这是通过肿瘤外泌体RNA和Toll样受体3(TLR3)实现的。 TLR3缺陷小鼠在自发性转移模型中表现出肺转移的降低。在机制上,原发肿瘤产生的外泌体RNA,主要是小的核内RNA(snRNA),在肺上皮细胞中激活TLR3,从而诱导肺中趋化因子的分泌以及中性粒细胞的募集。该研究团队的这一发现,揭示了肿瘤外泌体RNA和宿主肺上皮细胞的TLR3活化这条转移路径,这将为肿瘤肺转移提供了新的潜在治疗靶点。
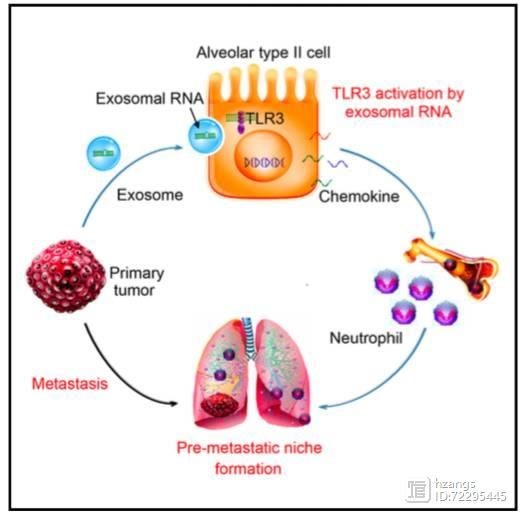
该发现的模式图
参考文献:
Liu et al.Tumor RNAs Lung Pre- Niche by TLR3 to .2016, Cell 30, 243–256.
发表评论