免疫治疗核心概念:CD8T细胞耗竭
- 健康知识
- 2024-04-04
- 145
什么是T细胞耗竭?
与急性感染和疫苗接种后,效应T细胞(Teff)和记忆T细胞(Tmem)细胞的发育不同,在抗原持续刺激的慢性感染和癌症期间,T细胞记忆不能有效地发展,T细胞变得精疲力竭,称之为T细胞耗竭(Tex)。Tex细胞在功能上有别于Teff和Tmem细胞,其特点是效应功能丧失,抑制性受体(IRS)表达增高和持续,表观和转录谱改变,代谢方式不同,不能过渡到Tmem细胞的静息、不依赖抗原的状态。
T细胞衰竭发生在许多其他慢性病毒感染中,包括HIV、丙型肝炎病毒(HCV)、乙型肝炎病毒(HBV)和其他持续感染以及自身免疫性疾病。
耗竭的T细胞从KRLG-记忆前体细胞发育而来
T细胞衰竭在癌症免疫功能障碍中起主要作用。肿瘤特异性CD8T细胞在人类癌症(包括但不限于)黑色素瘤、慢性髓系白血病、卵巢癌、非小细胞肺癌、霍奇金淋巴瘤和慢性淋巴细胞白血病中表现出T细胞衰竭和功能障碍的特征。肿瘤浸润淋巴细胞(TILs)主要表现为IRS高表达、效应功能差、转录和表观遗传学差异。
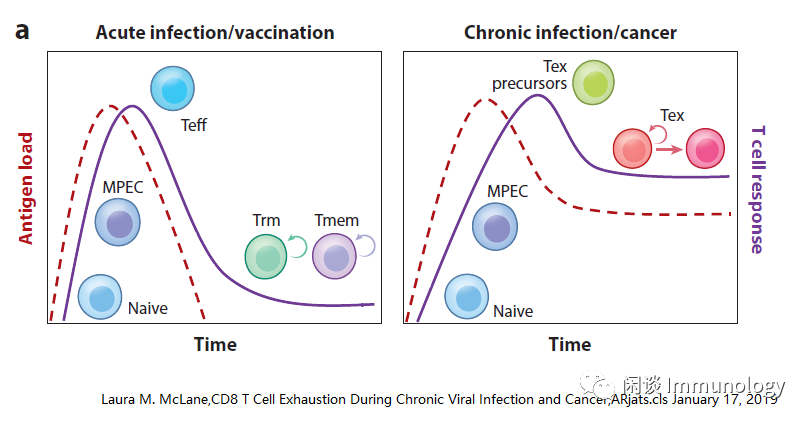
T细胞耗竭的特征
严重衰竭的CD8 T细胞最初在慢性持续性感染中被发现,Tex细胞会以一种渐进和分级的方式丧失效应功能。
白细胞介素-2(IL-2)的丢失发生在早期,其次是肿瘤坏死因子(TNF)的产生缺陷。细胞毒性也可以在这一阶段的衰竭。干扰素-γ的稳健生产缺陷发生在较严重的衰竭阶段,并与最终耗尽的T细胞有关。Tex细胞可能保留产生趋化因子的能力,包括MIP-1α,MIP-1β,和,以及在某些环境下产生IL-10的能力。衰竭的严重程度往往与病原体负荷、CD4T细胞的辅助和/或感染的持续时间有关;因此,可能会出现一系列的衰竭状态,导致不同程度的CD8 T细胞功能障碍。
一般来说,Tex细胞功能的精确模式因疾病而异,与病原体负担、病原体复制的模式和位置、抗原表达以及炎症环境有关。事实上,不同持续存在的慢性人类病毒导致了病毒特异性CD8 T细胞的不同表型。此外,最近的高维流式细胞术研究揭示了大约9种Tex细胞亚型,这些亚型很可能反映了耗尽核心程序的环境调节。这些Tex细胞的指纹图谱不仅可以推断Tex细胞分化状态的特征,而且还可以为针对与疾病相关的Tex细胞亚型提供潜在的免疫治疗机会。
Tmem细胞的一个关键特性是通过细胞因子IL-7和IL-15以不依赖抗原的方式维持细胞的功能。在急性解决感染或疫苗接种后,培养的Tmem细胞逐渐上调IL-7Rα和IL-2/15Rβ,并获得缓慢、稳定的稳态自我更新能力,这对于长期维持抗原无关的Tmem特性是必不可少的。
在慢性感染过程中,病毒特异性的Tex细胞由于IL-7Rα和IL-2/15Rβ信号通路的缺陷,无法进行IL-7和IL-15介导的内稳态增殖。虽然IL-2/15Rβ信号通路能促进Tex细胞的存活,但Tex细胞中存在IL-7Rα表达和信号缺失和IL-15敏感通路缺陷。相反,Tex细胞是通过持续的抗原信号来维持的,这些抗原信号驱动Tex细胞亚群的持续增殖。末端Tex细胞失去了对额外增殖信号的反应能力,并且对未来的刺激没有反应。
记忆稳态的改变也是人类Tex细胞的一个特征,因为在HIV和HCV感染中,许多Tex细胞在抗病毒治疗或病毒逃逸后会丢失,这意味着一种依赖抗原的生活方式。
T细胞的一个关键特征是多IRS的增加和持续表达。发现通过阻断PD-1与PD-L1的相互作用可以部分地逆转T细胞耗竭。近些年,越来越多的抑制性受体被发现,见下表:
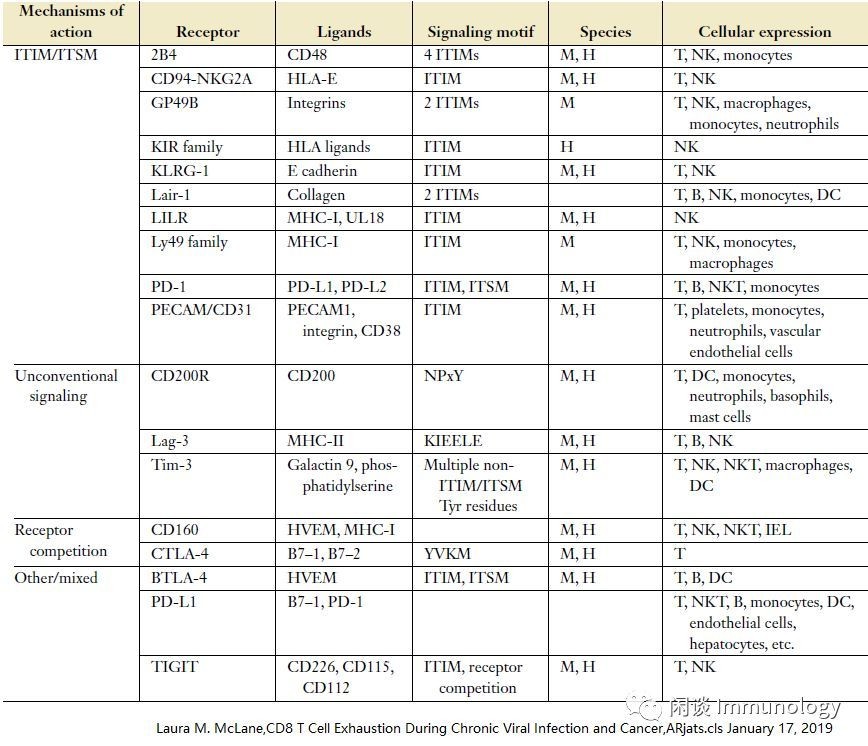
抑制性受体,在Teff有短暂表达,以 确保在其发挥完作用后,功能被抑制,维持免疫稳态避免自身免疫性疾病。在许多慢性感染和癌症中,多个IRS的共同表达是Tex细胞的共同特征。此外,IR共表达的程度和可能特定的模式直接对应于衰竭的严重程度。阻断PD-1信号可使Tex细胞恢复活力,但不完全,同时阻断多个IRS协同T恢复Tex细胞活性,这种联合靶向是目前治疗癌症的主要临床治疗策略。
淋巴细胞的一个主要特征是它们在激活和对周围环境变化的反应中的代谢可塑性。在急性感染期间,CD8 T细胞从线粒体氧化磷酸化从静止状态转化到糖酵解,以满足活化的Teff细胞所需的生物能量需求。
Tex细胞的转录图谱显示参与代谢的基因发生了重大变化,包括柠檬酸周期,表明代谢失调伴随着T细胞衰竭。在体外,PD-1交联减弱PI3K、Akt和mTOR信号,直接影响代谢途径,包括抑制糖酵解。在体内,发育中的Tex细胞表现出代谢紊乱,包括抑制细胞呼吸、降低葡萄糖摄取和线粒体能量失调。
这些发育中的Tex细胞似乎没有代谢储备,也没有获得类似Tmem的呼吸能力的代谢生活方式。这些代谢缺陷包括PGC1α和Foxo 1通路。这些效应的一个潜在联系是,一些IRS,如CTLA-4和PD-1,可能通过一种糖酵解的正调节因子CD28来负调控信号。在人类疾病(如HBV)中,至少观察到了T细胞衰竭过程中的一些代谢变化。此外,代谢失调也会导致肿瘤微环境的衰竭。肿瘤的生长通常由有氧糖酵解支持,有效的Teff细胞使用同样的代谢生活方式。此外,肿瘤本身的免疫抑制代谢副产品可能抑制T细胞功能,肿瘤细胞和免疫细胞之间争夺葡萄糖、其他燃料来源(例如脂肪酸)和氧气可能会促进耗竭。
由于PD-1信号与代谢途径之间的联系,PD-1阻断的影响对Tex细胞的代谢进行了研究。实际上,PD-1阻断再次引发合成代谢,在Tex细胞以mTOR依赖的方式代谢和糖酵解。此外,阻断PD-1信号增强葡萄糖摄取,主要由祖细胞Tex亚群.在此外,阻断PD-1通路导致肿瘤微环境中葡萄糖的增加。这也可能有助于改善TIL功能和肿瘤消退。这些研究结果表明,细胞代谢可能是免疫治疗的一个重要方面目的是逆转T细胞衰竭,事实上,代谢药物,如雷帕霉素和二甲双胍正在调查中。
与Teff和TMEM细胞相比,Tex细胞现在被认为有一个独特的转录程序。基因表达的变化包括编码IRS,转录因子的基因,控制TCR信号通路、共刺激和细胞因子信号以及细胞代谢的基因的显著改变。
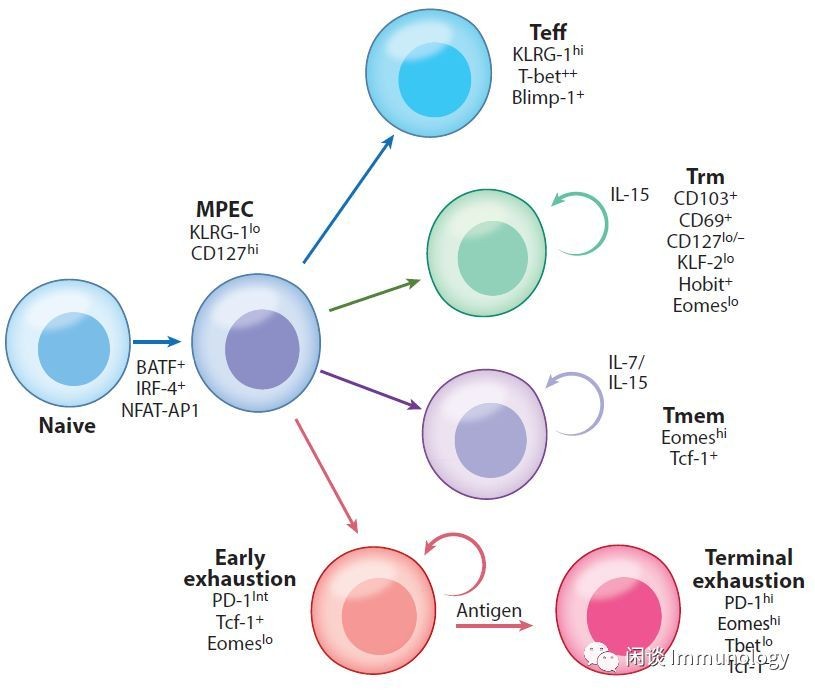
Laura M. ,C ,.cls 17, 2019
T细胞耗竭的相关调节因素
慢性感染或癌症的一个关键特征是T细胞持续接触抗原,高抗原负载和长时间的抗原暴露都会导致更严重的T细胞衰竭。慢性LCMV和未经治疗的病毒HBV、HCV和HIV等持续感染通常表现为与高抗原刺激相一致的严重衰竭。在慢性感染期间启动的CD8 T细胞如果在感染的第一至三周被过继转移到未感染的小鼠中,就可以恢复并发展为Tmem细胞。然而,长期接触慢性感染会导致不可逆的耗竭。这一时间也符合转录和表观遗传学规划中的拐点,即在慢性感染或肿瘤发展的大约2到3周时,衰竭的分子程序就会建立起来。即使在既定的慢性感染期间,CD8 T细胞的反应也会随着时间的推移而逐渐减弱,特别是当病毒载量很高的时候。
T细胞耗竭的免疫疗法
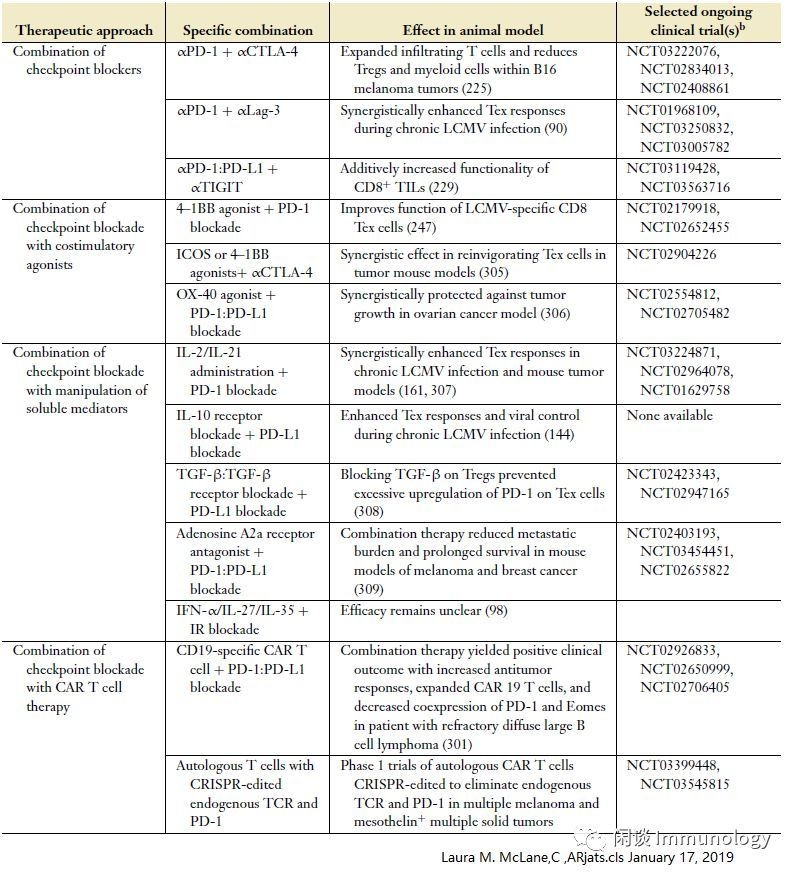
上表为联合免疫疗法临床试验
参考文献
EJ. 2011. T cell . Nat. . 12:492–99
TA, . 2012. 37:1130–44
. 1993, 362:758–61
Day CL,. 2006. 443:350–54
Laura M. ,C ,.cls 17, 2019
EJ, . Nat. Rev. .15:486–99
发表评论